Nível de energia
- Os níveis de camada de elétrons ou energia serão as distâncias especificadas do núcleo de um átomo onde os elétrons podem ser encontrados ou a maior probabilidade de serem encontrados. Elétrons são partículas carregadas negativamente dentro de uma molécula que se movem ao redor do núcleo positivo, geralmente localizado no centro. Os níveis de energia são mais ou menos como as medidas dos saltos de elétrons de uma etapa.
- Na maioria dos conceitos fundamentais de um átomo; consistem em elétrons orbitando ao redor de um núcleo.
- Porém, os elétrons não são capazes de escolher qualquer órbita como desejam. Os elétrons estão restritos a órbitas com apenas um determinado nível de energia. Os elétrons só são capazes de pular de um nível de energia ou passar para outro nível. Os elétrons não podem orbitar com nenhuma energia diferente dos níveis de energia especificados.
Qual é o diagrama de nível de energia?
Nível de energia significa avaliar a quantidade de energia que o elétron pode exigir e será liberado durante a transição, se saltarem de uma órbita para outra. O estado fundamental ou zero é o estado mínimo de energia calculado para H2 Moléculas.

Quais são os quatro níveis de energia?
Existem quatro tipos de orbitais - s, p, d e f.
- Sharp-s
- Princípio-p
- Difuso-d
- Fundamental-f
Em um átomo, existem algumas combinações destes orbitais.
O nível de energia é uma quantidade de espaço ou regiões, onde quer que elétrons provavelmente estará presente. Essas distâncias, conhecidas como orbitais, são de diferentes formas, denotadas por uma letra (s, p, d, f).

Geek3, Nuvens orbitais atômicas spdf m0, CC BY-SA 4.0
Como você determina os níveis de energia?

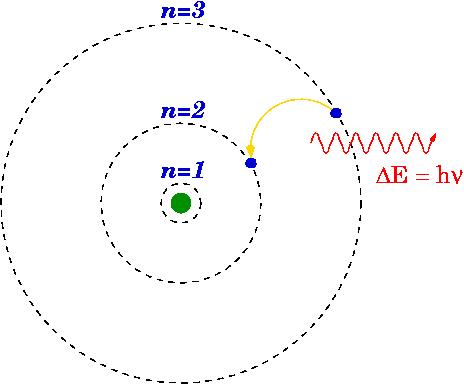
Bruce Blaus, Blausen 0342 Níveis de Energia Eletrônica, CC BY 3.0
elétrons de valência
“Os elétrons que estão no nível de energia mais alto são chamados de elétrons de valência.”
Estado Fundamental
“O estado de equilíbrio de energia mínimo do H2 átomo é reconhecido como o estado fundamental. ”
Estado de excitação
Quando o elétron (ou átomo) tem energia mais alta do que essa energia mais baixa, diz-se que está em um "estado excitado".
Se um elétron cai de um nível superior para um inferior, um fóton pode emitir ou liberar energia.
Diferença de energia
A energia do fóton emitido é a diferença entre os níveis de energia do primário (n i ) e final (n f ) Estado. A energia do fóton emitido é calculada usando a fórmula de Rydberg.
O modelo de Bohr de hidrogênio
Em 1913, Niels Bohr conceituou os níveis de energia e frequência espectraln do H2 ao considerar várias suposições simples para corrigir a hipótese clássica. A maioria dessas falhas foi resolvida pela modificação de Arnold Summerfield do modelo de Bohr. Por este modelo, o físico Niels Bohr recebeu o Prêmio Nobel de Física no ano de 1922.
No conceito fundamental de que um átomo (o modelo atômico de Bohr), os elétrons estão girando apenas algumas órbitas ao redor do núcleo. Acontecem os elétrons descendo e subindo entre as órbitas permitidas, além da emissão ou absorção de energia.
Embora este modelo básico não seja bem aceito porque a maioria da estrutura dos átomos é mais complicada do que o hidrogênio, embora isso necessite de novos assuntos, daí a introdução da mecânica quântica, na mecânica quântica, cada elétron em órbita é explicado por uma expressão matemática conhecida como uma função de onda.
Salgueiro W, Modelo de átomo de Bohr, CC BY-SA 3.0
Raio de Bohr
“O raio de Bohr (a0) é um parâmetro constante, é igual à distância mais previsível para o átomo de hidrogênio entre o núcleo e o elétron no estado fundamental (não relativístico e com um próton infinitamente pesado)"
Recebeu o nome de Niels Bohr por causa de sua parte no modelo de Bohr de um átomo.

SE3-29X, Hidrogênio GIF, CC BY-SA 4.0
Linhas espectrais
Cada componente possui um conjunto específico de níveis de energia. Assim, as frequências em que ele absorve e emite luz se comportam como uma espécie de microfone, identificando o composto específico e o particular. Essas características dos átomos têm dado investigações em assuntos chamados espectroscopia, uma ciência dedicada a identificar moléculas e átomos a partir do tipo de radiação que absorvem ou emitem.
Série Balmer
O físico atômico Balmer notou analiticamente uma relação nas energias durante a liberação de fótons do átomo. As várias energias / comprimentos de onda discretos de fótons que foram descobertos por Balmer são chamadas de série de Balmer.
Mais tarde, soube-se que as transições de energia criam as linhas de Balmer a partir do átomo de hidrogênio. O modelo de Bohr do átomo conseguiu definir a série de Balmer porque órbitas maiores precisavam de elétrons para ter significativamente mais potência adversa ou energia negativa para equilibrar com o momento angular. A fórmula de Rydberg oferece uma visão ampla da série Balmer para todos os ajustes de nível de energia.
Espectro de emissão
A Espectro de emissão de hidrogênio atômico foi dividido em várias séries espectrais e comprimentos de onda fornecidos pela fórmula de Rydberg padrão. Essas linhas espectrais detectadas são o resultado da transição de elétrons de diferentes níveis de energia em um átomo.
Um espectro de emissão denota a variedade de comprimentos de onda emitidos por um átomo ou composto químico estimulado por aquecimento ou corrente elétrica. O espectro de emissão de gás em combustão ou outras moléculas também pode ser utilizado para exemplificar sua composição.
Crédito de imagem: Ranjithsiji, Espectro de emissão atômica de hélio, CC BY-SA 4.0
Energia potencial
“Esta é a energia de uma entidade para a sua posição em relação a outros objetos, tensões, carga elétrica armazenada ou outros fatores dentro de si. ”
Energia de ligação
“A energia de ligação é a energia mínima necessária para manter um núcleo unido.”
Energia de ionização
"A quantidade de energia que um átomo isolado no estado eletrônico do solo precisava ser absorvida para ser descarregado como um e- “
A energia de ionização é descrita como uma etapa de dificuldade na remoção de um elétron em um átomo ou íon ou na proficiência de um átomo ou íon para entregar um elétron. O não da redução de elétrons geralmente ocorre no estado fundamental da espécie.
As energias de ionização são medidas em kJ / mol, ou a quantidade de energia necessária para que todos os átomos em um mol se soltem a unidade e- respectivamente.
Como funciona a energia de ionização?
Energia de ionização é a energia necessária, na qual um átomo gasoso isolado do estado eletrônico fundamental deve absorver para liberar um elétron. Quanto mais elétrons perdidos, maior será o íon e será mais difícil separar o e- do átomo.
Qual elemento tem a energia de ionização mais alta e mais baixa?
- O elemento He possui a maior energia de ionização.
- Francium tem a energia mínima de ionização.
A energia de ionização de um elemento aumenta da esquerda para a direita em uma tabela periódica e diminui de cima para baixo, geralmente na tabela periódica.
CDang e Adrignóla, Tabela periódica de energia de ionização, CC BY-SA 3.0
Para mais informações sobre a nuvem de elétrons Clique aqui
Leia também:
- A energia potencial é energia armazenada
- Tipos de energia cinética
- Exemplo de energia elétrica em energia radiante
- Exemplo de energia mecânica para elétrica
- Energia gravitacional em energia mecânica
- Fórmula de energia eólica
- A massa afeta a energia potencial
- Energia radiante em energia química
- Energia química em energia sonora
- Exemplo de energia cinética para sonora

Eu sou Subrata, Ph.D. em Engenharia, mais especificamente interessado em domínios relacionados com ciências Nucleares e Energéticas. Tenho experiência em vários domínios, desde engenheiro de serviço para drives eletrônicos e microcontroladores até trabalho especializado de P&D. Trabalhei em vários projetos, incluindo fissão nuclear, fusão em energia solar fotovoltaica, projeto de aquecedores e outros projetos. Tenho um grande interesse no domínio da ciência, energia, electrónica e instrumentação, e automação industrial, principalmente devido à vasta gama de problemas estimulantes herdados deste campo, e que todos os dias estão a mudar com a procura industrial. Nosso objetivo aqui é exemplificar esses assuntos científicos complexos e não convencionais de uma maneira fácil e compreensível.

Olá caro leitor,
Somos uma equipe pequena na Techiescience, trabalhando duro entre os grandes players. Se você gostou do que viu, compartilhe nosso conteúdo nas redes sociais. Seu apoio faz uma grande diferença. Obrigado!