Como Encontrar a Reação Redox

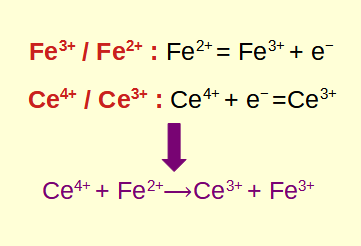

reações redox, abreviação de reações de oxidação-redução, são processos químicos fundamentais que envolvem a transferência de elétrons entre reagentes. Compreender como identificar e calcular reações redox é crucial nas áreas de química e biologia. Nesta postagem do blog, exploraremos os fundamentos das reações redox, aprenderemos como identificá-las, nos aprofundaremos nos cálculos envolvidos e exploraremos suas aplicações práticas.
Compreendendo os princípios básicos das reações redox
As reações redox ocorrem quando há uma transferência de elétrons entre duas espécies. Uma espécie perde elétrons (sofre oxidação) enquanto a outra espécie ganha elétrons (sofre redução). Essa transferência de elétrons é impulsionada por uma diferença na eletronegatividade dos átomos envolvidos.
A espécie oxidada é conhecida como agente redutor porque doa elétrons, enquanto a espécie reduzida é chamada de agente oxidante porque aceita elétrons. É importante notar que as reações redox sempre envolvem oxidação e redução, daí o nome.
Importância das reações redox
as reações redox desempenham um papel crucial em vários processos químicos e biológicos. Eles estão envolvidos na produção de energia, na corrosão, na síntese de produtos químicos e até no funcionamento do nosso próprio corpo. Por exemplo, o processo de fosforilação oxidativa, que ocorre nas mitocôndrias das nossas células, depende de reações redox para produzir ATP, a moeda energética universal das células.
Exemplos comuns de reações redox
Vamos dar uma olhada em alguns exemplos comuns de reações redox:
Combustão: Quando uma substância reage com o oxigênio para produzir calor e luz, é uma reação redox. Por exemplo, a queima de madeira ou a combustão de gasolina no motor de um carro.
Ferrugem: O processo de ferrugem envolve a oxidação do ferro na presença de oxigênio e água. O ferro perde elétrons, formando óxido de ferro (III) (ferrugem).
Fotossíntese: Durante a fotossíntese, as plantas convertem dióxido de carbono e água em glicose e oxigênio, com a ajuda da luz solar. Este processo envolve a redução do dióxido de carbono e a oxidação da água.
Identificando reações redox
Para identificar uma reação redox, precisamos reconhecer as substâncias que estão sofrendo oxidação e redução. Aqui estão algumas etapas importantes para nos ajudar a identificar reações redox rapidamente:
Reconhecendo oxidação e redução: Procure mudanças nos estados de oxidação ou perda/ganho de elétrons. Se o estado de oxidação de um elemento aumenta, ele está sendo oxidado, enquanto uma diminuição no estado de oxidação indica redução.
Determinando o número de oxidação: O número de oxidação é um conceito usado para determinar a distribuição de elétrons em um composto ou íon. Ajuda-nos a identificar a mudança nos estados de oxidação durante uma reação redox.
Identificação rápida de reações redox: Um método eficaz para identificar reações redox é procurar a presença de certos elementos ou compostos conhecidos por sofrerem reações redox. Por exemplo, o peróxido de hidrogênio (H2O2) é um agente oxidante comum, enquanto substâncias como o borohidreto de sódio (NaBH4) são agentes redutores.
Cálculo de reações redox
Depois de identificarmos uma reação redox, podemos prosseguir com o seu cálculo. Veja como:
Encontrando as meias reações: Divida a reação redox em duas meias reações, uma representando a oxidação e a outra representando a redução. Isso ajuda a equilibrar a equação mais tarde.
Equilibrando a reação redox: Equilibre o número de átomos em cada lado da equação ajustando os coeficientes. É essencial equilibrar massa e carga ao lidar com reações redox.
Cálculo da reação redox geral: Combine as semi-reações balanceadas, garantindo que o número de elétrons ganhos na redução corresponda ao número de elétrons perdidos na oxidação.
Conceitos Avançados em Reações Redox
Para aprofundar nossa compreensão das reações redox, vamos explorar alguns conceitos avançados:
Determinando a espontaneidade de reações redox: A espontaneidade de uma reação redox pode ser determinada usando o conceito de potencial redox. Se o potencial redox for positivo, a reação é espontânea, indicando maior probabilidade de ocorrência.
Encontrando o coeficiente de reações redox: Os coeficientes em uma reação redox balanceada representam o número relativo de moles de cada espécie envolvida. Esses coeficientes são cruciais para cálculos estequiométricos.
Compreendendo o papel dos elétrons nas reações redox: Os elétrons são os transportadores de carga nas reações redox. Eles viajam do agente redutor para o agente oxidante, facilitando a transferência de energia.
Aplicações Práticas de Reações Redox
As reações redox têm aplicações práticas em vários domínios. Vamos explorar alguns exemplos:
reações redox na vida cotidiana: O processo de respiração em nossos corpos depende de reações redox para converter glicose em energia. Além disso, as baterias que usamos diariamente, como as baterias alcalinas e as baterias de íon-lítio, operam com base em reações redox.
Aplicações Industriais de Reações Redox: As reações Redox são cruciais em processos industriais como extração de metal, galvanoplastia e tratamento de águas residuais. Eles ajudam a remover poluentes nocivos e a convertê-los em substâncias menos tóxicas.
reações redox em sistemas biológicos: No corpo humano, as reações redox estão envolvidas em vários processos biológicos, incluindo metabolismo, desintoxicação e respostas imunológicas. No entanto, reações redox excessivas podem levar ao estresse oxidativo, que pode danificar as células e contribuir para doenças.
Leia também:
- Reação de Knoevenagel
- Exemplo de reação dependente de luz
- reação endotérmica
- Reação de substituição nucleofílica
- Exemplo de reação de síntese
- Reação fotoquímica
- Exemplo de reação endergônica
- Exemplo de reação de primeira ordem
- Exemplo de reação independente de luz
- Reação de Kolbe

Olá,
Sou Aditi Ray, uma PME de química nesta plataforma. Concluí a graduação em Química pela Universidade de Calcutá e a pós-graduação pela Techno India University com especialização em Química Inorgânica. Estou muito feliz por fazer parte da família Lambdageeks e gostaria de explicar o assunto de forma simplista.
Vamos nos conectar através do LinkedIn - https://www.linkedin.com/in/aditi-ray-a7a946202

Olá caro leitor,
Somos uma equipe pequena na Techiescience, trabalhando duro entre os grandes players. Se você gostou do que viu, compartilhe nosso conteúdo nas redes sociais. Seu apoio faz uma grande diferença. Obrigado!